- Auteur Jason Gerald [email protected].
- Public 2023-12-16 11:11.
- Dernière modifié 2025-01-23 12:18.
Si vous trouvez le tableau périodique confus et difficile à comprendre, ne vous inquiétez pas, vous n'êtes pas seul ! Comprendre comment fonctionne le tableau périodique peut être difficile, mais en apprenant à le lire, vous réussirez en science. Commencez par comprendre la structure du tableau périodique et les informations qu'il montre sur les éléments. Ensuite, vous pouvez étudier chacun des éléments. Enfin, utilisez les informations répertoriées dans le tableau périodique pour connaître le nombre de neutrons dans un atome.
Étape
Partie 1 sur 3: Comprendre la structure du tableau périodique
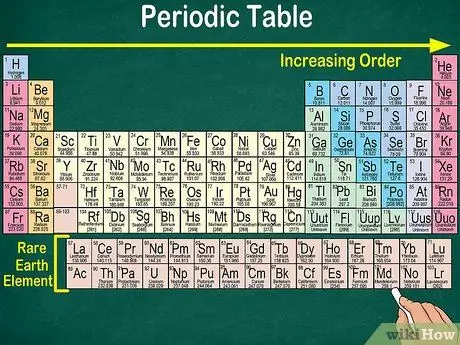
Étape 1. Lisez le tableau périodique du haut à gauche vers le bas à droite
Les éléments sont disposés selon leur numéro atomique. Plus on va vers la droite et vers le bas, plus le numéro atomique est élevé. Le numéro atomique est le nombre de protons que possède l'atome d'un élément. En allant plus loin vers la droite, vous remarquerez également que le nombre de masse de chaque atome augmente. C'est-à-dire que vous pouvez comprendre le poids d'un élément même simplement en regardant son emplacement sur la table.
- Plus vers la droite ou vers le bas, la masse atomique de l'élément augmentera car la masse atomique est calculée en additionnant les protons et les neutrons dans chaque atome de l'élément. Le nombre de protons augmente avec l'élément, ce qui signifie que son poids augmente également.
- Les électrons ne sont pas inclus dans la masse atomique car par rapport aux protons et aux neutrons, les électrons n'ont pas beaucoup d'effet sur le poids atomique.

Étape 2. Comprenez que chaque élément contient 1 proton de plus que l'atome à sa gauche
Vous pouvez le dire en regardant le numéro atomique. Les numéros atomiques sont disposés de gauche à droite. Les éléments sont également séparés en 3 groupes, vous pouvez voir le regroupement dans le tableau.
Par exemple, la première ligne répertorie l'hydrogène, qui a le numéro atomique 1, et l'hélium, qui a le numéro atomique 2. Cependant, ces deux éléments sont situés à l'extrême gauche et à droite du tableau car ils sont dans des groupes différents
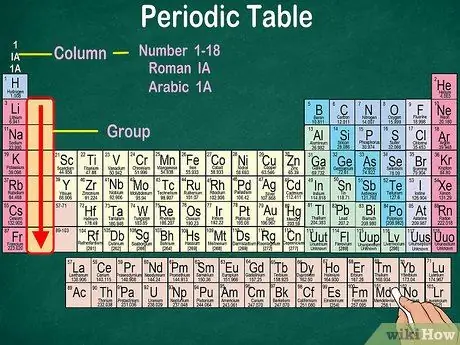
Étape 3. Identifiez des groupes d'atomes qui ont les mêmes propriétés physiques et chimiques
Les groupes sont indiqués par des colonnes verticales. Dans la plupart des cas, les groupes sont caractérisés par la même couleur. Cela vous aide à identifier les éléments ayant des propriétés physiques et chimiques similaires. Cela vous permettra de prévoir plus facilement les réactions de ces éléments. Chaque élément d'un groupe donné a le même nombre d'électrons dans son orbitale la plus externe.
- La plupart des éléments n'appartiennent qu'à un seul groupe. Cependant, l'hydrogène peut être classé comme un halogène ou un métal alcalin. Dans certains tableaux, l'hydrogène apparaît dans les deux groupes.
- Dans la plupart des cas, les colonnes seront numérotées de 1 à 18, en haut ou en bas du tableau. Les chiffres peuvent être affichés en chiffres romains (IA), en chiffres arabes (1A) ou en chiffres (1).
- Lisez les groupes atomiques de haut en bas.
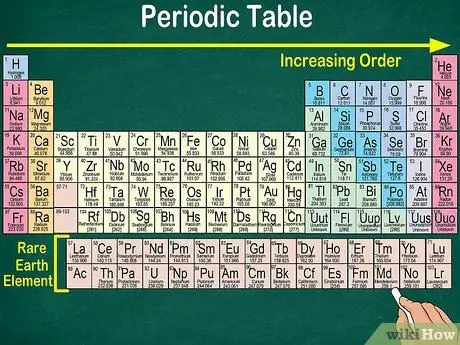
Étape 4. Notez l'espace vide dans le tableau
En plus du numéro atomique, la disposition des éléments en groupes et en groupes prend également en compte les mêmes propriétés physiques et chimiques. De cette façon, vous comprendrez mieux comment chaque élément réagit. L'ajout d'éléments chimiques rend leur classification plus difficile, il n'est donc pas surprenant que le tableau périodique contienne des espaces vides.
- Par exemple, les 3 premières lignes ont des espaces vides, car les métaux de transition qui apparaissent dans le tableau sont des éléments de numéro atomique 21.
- De même, les éléments 57 à 71, qui sont des terres rares ou des terres rares, sont représentés séparément en bas à droite du tableau.
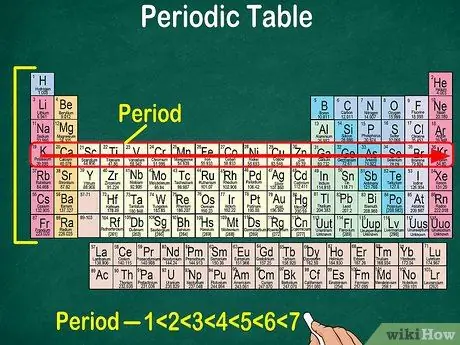
Étape 5. Notez que chaque ligne est appelée un point
Tous les éléments d'une période ont le même nombre d'orbitales atomiques, à travers lesquelles passeront les électrons. Le nombre d'orbitales correspondra au nombre de périodes. Le tableau périodique comporte 7 lignes, ce qui signifie qu'il y a 7 périodes.
- Par exemple, un élément de la période 1 a 1 orbitale, tandis qu'un élément de la période 7 a 7 orbitales.
- Dans la plupart des cas, les périodes sont numérotées de 1 à 7 de haut en bas sur le côté gauche du tableau.
- Lisez la période des éléments suivant la rangée de gauche à droite.
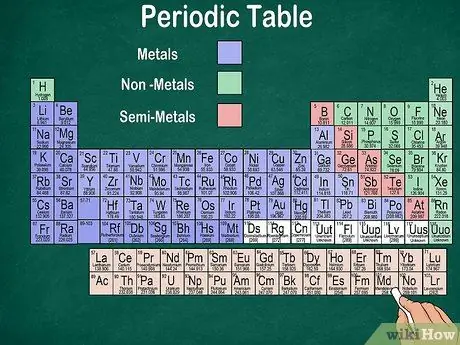
Étape 6. Distinguer les métaux, les semi-métaux et les non-métaux
Vous pouvez mieux comprendre les propriétés des éléments en reconnaissant le type d'élément. Heureusement, la plupart du tableau périodique utilise la couleur pour indiquer si un élément est un métal, un semi-métal ou un non-métal. Vous trouverez des éléments métalliques à droite de la table, tandis que des éléments non métalliques à gauche. Le groupe semi-métallique se situe entre les métaux et les non-métaux.
- Rappelez-vous que l'hydrogène peut être groupé avec les halogènes ou les métaux alcalins en raison de ses propriétés. Par conséquent, il est naturel que l'hydrogène apparaisse des deux côtés de la table ou soit d'une couleur différente.
- Un élément est appelé métal s'il est brillant, solide à température ambiante, conducteur de chaleur et d'électricité, et est mou et élastique.
- Un élément est considéré comme un non-métal s'il n'est pas brillant, ne conduit pas la chaleur ou l'électricité et est dur. Ces éléments sont généralement gazeux à température ambiante, mais peuvent également être solides ou liquides à certaines températures.
- Un élément est appelé semi-métal s'il possède les propriétés combinées d'un métal et d'un non-métal.
Partie 2 sur 3: Étudier les éléments
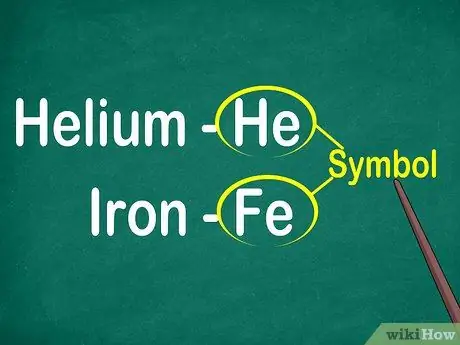
Étape 1. Identifiez les symboles des éléments de 1 à 2 lettres
Le symbole est généralement situé au centre d'un carré avec une grande police. Les symboles sont des abréviations pour les noms d'éléments, qui ont été normalisés dans diverses langues. Lorsque vous faites des expériences ou travaillez sur des équations élémentaires, vous utiliserez probablement des symboles d'élément. Par conséquent, que cela vous plaise ou non, vous devez vous familiariser avec les symboles élémentaires.
Les symboles sont généralement dérivés du nom latin de l'élément, mais sont parfois dérivés de noms largement utilisés, en particulier de nouveaux éléments. Par exemple, le symbole de l'hélium est He, qui représente ce nom bien connu. Cependant, le symbole du fer est Fe, ce qui est relativement difficile à repérer à première vue

Étape 2. Recherchez le nom complet de l'élément, le cas échéant
C'est le nom de l'élément que vous utiliserez si vous devez l'écrire en entier. Par exemple, "Hélium" et "Carbone" sont les noms des éléments. Dans la plupart des cas, le nom de l'élément se trouve sous le symbole, mais le placement peut varier.
Certains tableaux périodiques peuvent ne pas inclure le nom complet et n'utiliser que des symboles
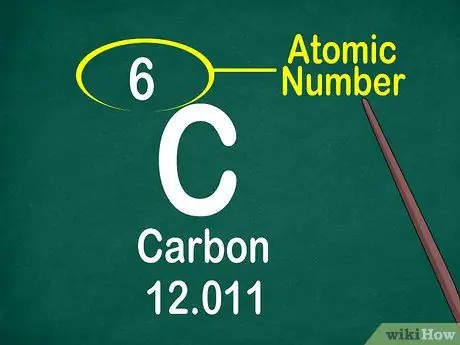
Étape 3. Notez le numéro atomique
Le numéro atomique est généralement situé en haut de la boîte, soit au milieu, soit dans le coin de la boîte. Cependant, le numéro atomique peut également être situé sous le symbole ou le nom de l'élément. Les numéros atomiques sont ordonnés de 1 à 118.
Le numéro atomique est un nombre entier, pas un nombre décimal
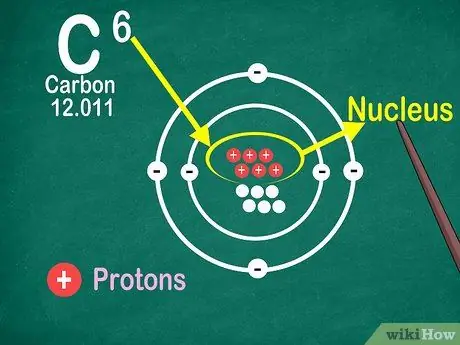
Étape 4. Sachez que le numéro atomique est le nombre de protons dans l'atome
Tous les atomes d'un élément ont le même nombre de protons. Contrairement aux électrons, les protons ne peuvent pas être capturés ou libérés par les atomes. Les éléments changeront si les atomes peuvent attraper ou perdre des atomes.
Vous avez également besoin du numéro atomique pour connaître le nombre d'électrons et de neutrons
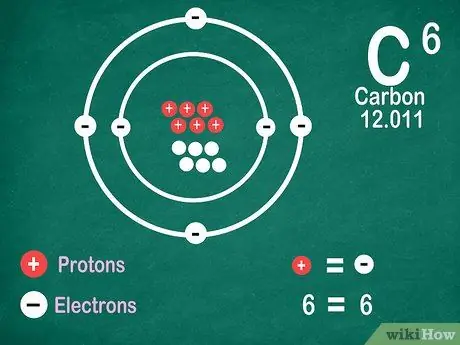
Étape 5. Sachez que les éléments contiennent le même nombre d'électrons que de protons, à moins que l'élément ne subisse une ionisation
Les protons ont une charge positive, tandis que les électrons ont une charge négative. Comme un atome neutre n'a pas de charge électrique, cela signifie qu'il a le même nombre d'électrons et de protons. Cependant, les atomes peuvent perdre et gagner des électrons, ce qui les rend ionisés.
- Les ions sont des charges électriques. S'il y a plus de protons dans un ion, la charge est positive, c'est-à-dire un signe positif (+) à côté du symbole de l'ion. Si le nombre d'électrons dans l'ion est supérieur, la charge est négative, ce qui est négative (-).
- Vous ne verrez pas de signe positif ou négatif si un atome n'est pas un ion.
Partie 3 sur 3: Utilisation du poids atomique pour compter les neutrons

Étape 1. Connaître le poids atomique
Le poids atomique est généralement situé au bas de la boîte, sous le symbole de l'élément. Le poids atomique est le poids combiné des particules dans le noyau atomique, y compris les protons et les neutrons. Cependant, les ions peuvent compliquer le processus de comptage. Ainsi, le poids atomique indique la masse atomique moyenne de l'élément et la masse atomique de ses ions.
- En raison de leur poids moyen, la plupart des atomes ont des poids atomiques sous forme décimale.
- Bien que le poids d'un élément semble augmenter de gauche à droite, ce n'est pas toujours le cas.
Étape 2. Déterminez le nombre de masse de l'élément que vous étudiez
Vous pouvez trouver le nombre de masse en arrondissant la masse atomique. Ce fait prouve que le poids atomique est la moyenne de toutes les masses atomiques, y compris les ions.
Par exemple, le poids atomique du carbone est de 12 011, il est donc arrondi à 12. De même, le poids atomique du fer est de 55,847, il est donc arrondi à 56
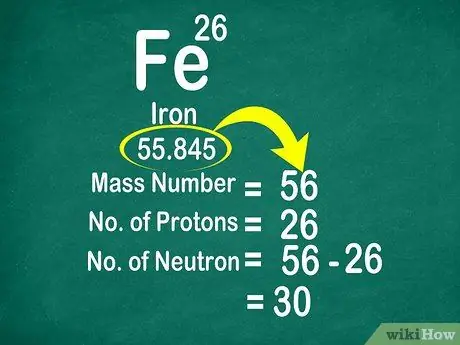
Étape 3. Soustrayez le nombre de masse du numéro atomique pour compter les neutrons
Le nombre de masse peut être calculé en ajoutant le nombre de protons au nombre de neutrons. Cela vous permettra de calculer plus facilement le nombre de neutrons dans un atome, en soustrayant le nombre de masse du nombre de protons
- Utilisez cette formule: Neutron = Nombre de masse - Proton
- Par exemple, le nombre de masse du carbone est 12 et a 6 protons. Ainsi, nous pouvons savoir que le Carbone a 6 neutrons car 12 - 6 = 6.
- Autre exemple, le nombre de masse du fer est de 56 et possède 26 protons. Ainsi, nous savons que le fer a 30 neutrons car 56 - 26 = 30.
- Les isotopes des atomes contiennent différents nombres de neutrons, de sorte que leur poids atomique change.
Des astuces
- La lecture du tableau périodique est difficile pour certaines personnes. Ne vous découragez pas si vous avez du mal à étudier le tableau périodique !
- Les couleurs du tableau peuvent varier, mais le contenu reste le même.
- Certains tableaux périodiques peuvent fournir des informations incomplètes. Par exemple, certains tableaux ne donnent que le symbole et le numéro atomique. Pour cela, cherchez une table qui correspond à vos besoins !






