- Auteur Jason Gerald gerald@how-what-advice.com.
- Public 2023-12-16 11:11.
- Dernière modifié 2025-06-01 06:06.
La dilution est le processus consistant à rendre une solution concentrée plus diluée. Il existe une variété de raisons pour lesquelles quelqu'un pourrait vouloir faire une dilution, allant des raisons sérieuses aux raisons simples. Par exemple, les biochimistes diluent des solutions à partir de leurs formes concentrées pour créer de nouvelles solutions à utiliser dans des expériences, tandis que, d'un autre côté, les barmans diluent souvent de l'alcool avec des boissons gazeuses ou des jus pour rendre les cocktails plus savoureux. La formule générale de calcul de la dilution est C1V1 = C2V2, avec C1 et C2 représente les concentrations initiale et finale de la solution, respectivement, et V1 et V2 représente le volume.
Étape
Méthode 1 sur 2: Dilution précise des concentrés via l'équation de dilution

Étape 1. Déterminez ce que vous savez et ne savez pas
La dilution en chimie signifie généralement prendre une petite quantité d'une solution dont vous connaissez la concentration, puis ajouter un liquide neutre (comme de l'eau) pour faire une nouvelle solution avec un volume plus important mais une concentration plus faible. Cela se fait très souvent dans les laboratoires de chimie, car, par souci d'efficacité, les réactifs sont souvent stockés à des concentrations très élevées, qui sont ensuite diluées pour être utilisées dans des expériences. Habituellement, dans la plupart des situations réelles, vous connaîtrez la concentration de votre solution initiale et la concentration ou le volume que vous voulez que votre concentration finale soit, mais pas le volume de solution initiale dont vous avez besoin pour obtenir la solution finale.
- Cependant, dans d'autres situations (en particulier dans les problèmes scolaires), vous devrez peut-être trouver d'autres pièces du puzzle - par exemple, on peut vous donner un volume et une concentration initiaux, puis vous demander de trouver la concentration finale si vous diluez une solution. au volume souhaité. Dans tous les cas de dilution, il est utile de noter les variables connues et inconnues avant de commencer.
-
Finissons les exemples de questions. Supposons qu'on nous demande de diluer une solution 5 M avec de l'eau pour faire 1 L d'une solution 1. mm. Dans ce cas, nous connaissons la concentration de notre solution initiale et le volume et la concentration finale que nous voulons, mais pas la quantité de solution initiale que nous devons ajouter avec de l'eau pour obtenir le résultat souhaité.
Rappel: En chimie, M est une mesure de concentration appelée Molarité, qui désigne les moles d'une substance par litre
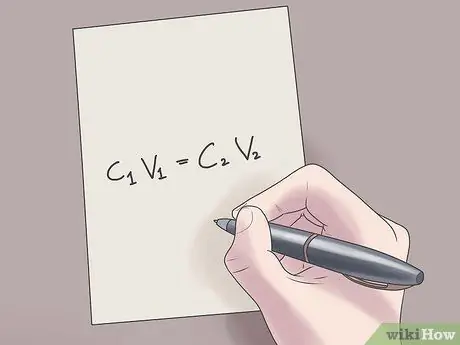
Étape 2. Insérez vos valeurs dans la formule C1V1 = C2V2.
Dans cette formule, C1 est la concentration initiale de la solution, V1 est le volume de la solution initiale, C2 est la concentration finale de la solution, et V2 est le volume de la solution finale. Le fait de brancher des valeurs connues dans cette équation vous aidera à trouver des valeurs inconnues avec moins de difficulté.
- Vous trouverez peut-être utile de placer un point d'interrogation devant l'unité que vous souhaitez rechercher pour vous aider à le résoudre.
-
Continuons notre exemple. Nous entrerons les valeurs que nous connaissons comme suit:
- C1V1 = C2V2
- (5 M)V1 = (1 mM) (1 L). Nos deux concentrations ont des unités différentes. Arrêtons-nous ici et passons à l'étape suivante.

Étape 3. Tenez compte des différences d'unité
Étant donné que les solutions impliquent des changements de concentration (qui peuvent parfois être assez importants), il n'est pas inhabituel que les deux variables de votre équation aient des unités différentes. Bien que cela soit facile à ignorer, des unités inégales dans votre équation peuvent rendre votre réponse incorrecte. Avant de terminer, convertissez toutes les valeurs avec différentes unités de concentration et/ou de volume.
-
Dans notre exemple, nous utilisons différentes unités pour les concentrations de M (molaires) et mM (millimolaires). Changeons notre deuxième mesure en M:
- 1 mM × 1 M/1 000 mM
- = 0,001 millions

Étape 4. Terminez
Une fois que toutes les unités sont égales, résolvez votre équation. Cela peut presque toujours être fait avec de l'algèbre simple.
-
On arrête notre exemple de problème ici: (5 M)V1 = (1 mM) (1 L). Trouvons la valeur de V1 avec notre nouvelle unité.
- (5 M)V1 = (0,001 M) (1 L)
- V1 = (0,001 M) (1 L)/(5 M).
-
V1 = 0,0002 L, ou 0,2 ml.

Étape 5. Comprenez comment utiliser correctement votre réponse
Disons que vous avez trouvé votre valeur manquante, mais que vous ne savez pas comment utiliser ces nouvelles informations dans la dilution réelle que vous devez faire. C'est compréhensible - le langage des mathématiques et des sciences ne correspond parfois pas au monde réel. Quand on connaît les quatre valeurs de l'équation C1V1 = C2V2, faire la dilution comme suit:
- Mesurer le volume V1 à partir d'une solution avec une concentration de C1. Ensuite, ajoutez suffisamment de diluant (eau, etc.) pour obtenir le volume total V2. Cette nouvelle solution aura la concentration que vous désirez (C2).
- Dans notre exemple, par exemple, nous mesurons d'abord 0,2 mL d'une solution 5 M. Ensuite, nous ajouterons suffisamment d'eau pour augmenter le volume de la solution à 1 L: 1 L - 0,0002 L = 0,9998 L, soit 999, 8 mL. En d'autres termes, nous ajouterons 999,8 ml d'eau à notre petit échantillon de solution. Notre nouvelle solution diluée a une concentration de 1 mM, qui est notre concentration souhaitée.
Méthode 2 sur 2: Faire une solution de dilution simple et pratique

Étape 1. Lisez tout emballage pour plus d'informations
Il existe diverses raisons pour lesquelles vous pourriez vouloir préparer une solution de dilution à la maison, dans la cuisine ou dans un autre laboratoire non chimique. Par exemple, faire du jus d'orange à partir d'un simple concentré est une dilution. Dans de nombreux cas, le produit à diluer contient des informations sur la dilution à effectuer, quelque part sur l'emballage. Ils peuvent avoir des instructions précises à suivre. Voici quelques éléments à rechercher lorsque vous recherchez des informations:
- Volume de produit utilisé
- Volume de diluant utilisé
- Type de diluant utilisé (généralement de l'eau)
- Instructions de mélange spéciales
- Il se peut que vous ne voyiez pas d'informations sur la concentration exacte du liquide utilisé. Cette information n'est pas utile au consommateur moyen.

Étape 2. Ajouter la substance qui agit comme diluant à la solution concentrée
Pour les dilutions ménagères simples, comme celles que vous pourriez faire dans la cuisine, il vous suffit de connaître le volume de concentré que vous utilisez et la concentration finale approximative que vous souhaitez avant de commencer. Diluer le concentré avec une quantité appropriée de diluant, qui est déterminée en fonction du volume du concentré initial utilisé. Voir ci-dessous:
- Par exemple, si nous voulions diluer 1 tasse de concentré de jus d'orange à 1/4 de sa concentration initiale, nous ajouterions 3 tasses l'eau dans le concentré. Notre mélange final contiendra 1 tasse de concentré dans 4 tasses de liquide entier - 1/4 de sa concentration initiale.
- Voici un exemple plus compliqué: si nous voulions diluer 2/3 tasse de concentré à 1/4 de sa concentration initiale, nous ajouterions 2 tasses d'eau, car 2/3 tasse équivaut à 1/4 fois 2&2/3 tasse du liquide entier.
- Assurez-vous d'ajouter votre substance dans un récipient suffisamment grand pour contenir le volume final souhaité - un grand bol ou un récipient similaire.

Étape 3. Ignorez le volume de poudre dans la plupart des cas
L'ajout d'une poudre (comme certains mélanges pour boissons) à un liquide n'est généralement pas considéré comme une dilution. Le changement de volume résultant de l'ajout d'une petite quantité de poudre au liquide est généralement suffisamment faible pour être négligeable. En d'autres termes, lorsque vous ajoutez une petite quantité de poudre à un liquide, ajoutez simplement la poudre au volume final de liquide souhaité et mélangez.
Avertissement
- Suivez toutes les consignes de sécurité fournies par le fabricant ou exigées par votre entreprise. Ceci est particulièrement important si vous devez diluer la solution acide.
- Travailler avec des solutions acides peut nécessiter des mesures de sécurité et des directives plus détaillées qu'avec des solutions non acides.






